Erkrankungen lassen sich nicht nur direkt – durch Identifikation des Krankheitserregers (des Antigens) – sondern auch indirekt (und rückblickend) durch das Vorhandensein spezifischer Antikörper nachweisen. Die zugrundeliegenden, hochspezifischen Antigen-Antikörper-Reaktionen sind die Basis der Serologie, einem Teilbereich der Immunologie. Serologische Blutuntersuchungen sind ein wichtiger Bestandteil der Infektionsdiagnostik und dienen dem Nachweis krankheitsspezifischer Antikörper in-vitro.
Der ELISafe 19™ COVID-19 IgG ELISA Detection Kit dient dem qualitativen Nachweis von IgG-Antikörpern gegen das S1-Fragment von SARS-CoV-2 aus humanen Serum- oder Plasmaproben. Durch diesen spezifischen Nachweis der Immunantwort lässt sich die durchlebte Covid-19 Erkrankung nach dem Abklingen der Symptome und nach Ende der infektiösen Phase diagnostizieren bzw. bestätigen.
ELISafe 19™ ist ausschließlich für die In-vitro-Diagnostik (CE-Kennzeichnung für IVD (98/79/EC)) bestimmt und bedarf geschultes medizinisches Fachpersonal.
Anwendungsbereiche
Ein positiver Nachweis mit dem ELISafe 19™ Kit belegt eine durchlaufene Covid-19 Erkrankung; in der Akutdiagnostik spielt der serologische Nachweis von SARS-CoV-2-Antikörpern entsprechend keine Rolle. IgG-Antikörper gegen SARS-CoV-2 sind in der Regel frühestens eine Woche nach Symptombeginn nachweisbar.
Indikationen für einen serologischen Test mit ELISafe 19™ sind:
z.B. bei Patient*innen mit symptomarmer oder asymptomatischer Erkrankung. Auch wenn der direkte Erregernachweis (Rachenabstrich) mittels RT-PCR bereits wieder negativ ist, lassen sich die IgG-Antikörpern noch über einen längeren Zeitraum bestimmen.
zur Klärung von Infektionsketten, Bewertung von Morbiditäts- und Mortalitätsraten und für Untersuchungen zur Herdenimmunität.
Die serologische Diagnostik kann entscheidende Erkenntnis über die gesellschaftliche Verbreitung einer Erkrankung liefern und dazu beitragen, effektive Schutzmaßnahmen und Strategien zu entwickeln.
von definierten Personengruppen wie medizinischem Personal, Pflegekräften etc. zur Identifikation genesener und potentiell immuner Personen.
bei kritischen Patient*innen (ab 5 Tage nach Symptombeginn) und von genesenen Personen, deren Plasma möglicherweise für Therapeutika verwendet werden kann.
zur Unterstützung Impfstoff-bezogener Studien.
Wie lange der IgG-Antikörpertiter nach einer SARS-CoV-2-Infektion messbar ist (und was das Vorhandensein oder Fehlen eines messbaren IgG-Titers für die Immunität des Einzelnen bedeutet), ist derzeit laut Robert-Koch Institut (Stand 14.01.2021) noch unklar.
Generell rät das RKI:
„Die Interpretation serologischer Testergebnisse muss unter Berücksichtigung der Vortestwahrscheinlichkeit, der jeweiligen epidemiologischen Situation sowie unter Kenntnis der Spezifitäts-/Sensitivitätswerte des verwendeten Testsystems erfolgen.“
Wie funktioniert's?
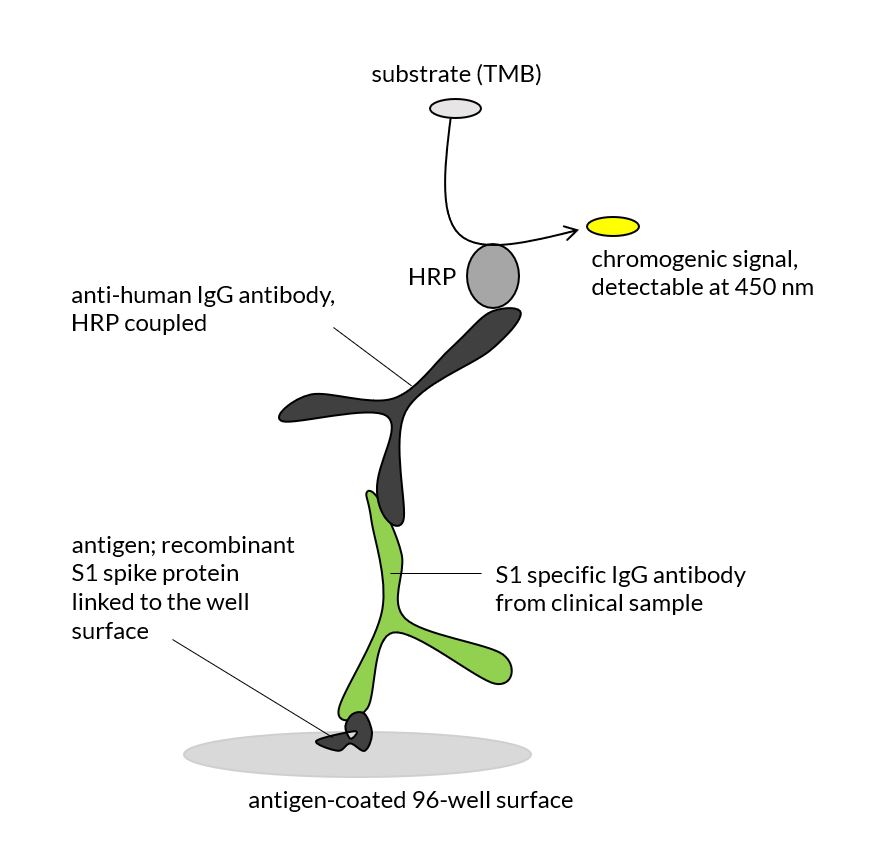
Der ELISafe 19™ Kit dient dem qualitativen Nachweis von Covid-19 IgG Antikörpern im menschlichen Blut. Das Assay-Prinzip ist ein indirekter ELISA-Test.
Die verdünnte Serum- oder Plasmaprobe des Patienten wird in die Mikrowell-Platte pipettiert. Diese ist mit dem viralen Antigen (S1 Spike-Protein, rekombinant) beschichtet. Sind in der Probe Covid-19 Antikörper enthalten, so binden diese spezifisch an die Plattenoberfläche und können im Anschluss durch HRP-gekoppelte anti-human IgGs detektiert werden. Für die Nachweisreaktion wird ein chromogenes Substrat (TMB) verwendet, welches im ELISA Mikroplatten-Reader (Plattenlesegerät) bei 450 nm ausgelesen wird.
Kit-Bestandteile
- 96-Well Mikroplatte, beschichtet mit dem S1 Spike-Protein (inklusive Rezeptor-Bindestelle) von SARS-CoV-2
- Plate Sealer
- Verschiedene Wasch-, Proben- und Antikörper-Puffer
- HRP-gekoppelter Anti-human IgG-Antikörper
- TMB (3,3′,5,5′-Tetramethylbenzidin) und Stopplösung
- Negativ- und Positivkontrolle
Validierung
Die Validierung des ELISafe 19™ Kits erfolgte mittels Serumproben molekularbiologisch bestätigter (also mit positiver RT-PCR Diagnostik) Covid-19 Patient*innen und negativen Serumproben, die vor Pandemiebeginn im Januar 2020 gewonnen wurden. Die daraus berechnete Sensitivität (bei Entnahme der Serumprobe 2 Wochen nach positivem Rachenabstrich) lag bei 99%, mit einer Spezifität (keine falsch-positiven Resultate) von 100 %.
